Ионная, водородная и металлическая связи
Донорно-акцепторная связь
Ковалентная связь, которая образуется по донорно-акцепторному механизму, называется донорно-акцепторной связью. При образовании донорно-акцепторной связи один атом (донор) предоставляет неподеленную пару электронов, которая становится общей электронной парой между ним и другим атомом (акцептором):
Донорно-акцепторная связь иногда обозначается стрелкой, которая направлена от атома-донора к атому-акцептору: А→В
Донорно-акцепторная связь образуется в результате перекрывания орбитали с неподеленной электронной парой атома-донора и свободной орбитали атома-акцептора:![]()
Донорно-акцепторная связь имеет такие же свойства, как и обычная ковалентная связь, а отличается от нее только происхождением общей электронной пары. Образование донорно-акцепторной связи рассмотрим на примере иона аммония NH4+. Этот сложный ион образуется в результате присоединения иона водорода Н+ к молекуле аммиака NH3:
NH3 + H+ = NH4+
Три неспаренных электрона, которые находятся на 2р-подуровне, участвуют в образовании трех ковалентных связей с атомами водорода в молекуле NH3. Это обычные связи, образованные по обменному механизму. Неподеленная электронная пара, которая находится у атома азота на 2s-подуровне, может участвовать в образовании донорно-акцепторной связи, т. е. атом азота в молекуле аммиака может быть донором электронной пары. Ион водорода вообще не имеет электронов, но имеет свободную 1s-орбиталь, поэтому он может быть акцептором электронов:

Все четыре связи N—H в ионе аммония являются равноценными. Это обусловлено тем, что в момент образования связи в атоме азота происходит гибридизация 2s-орбитали и трех 2р-орбиталей, т. е. sp3 -гибридизация. В результате возникают четыре одинаковые гибридные орбитали, которые направлены к вершинам тетраэдра. Таким образом, ион аммония, как и молекулы типа АВ4, имеет тетраэдрическую форму.
Обратите внимание, что валентность азота в ионе аммония равна IV, так как он образует четыре ковалентные связи.
Следовательно, если элемент образует ковалентные связи и по обменному, и по донорно-акцепторному механизму, то его валентность больше числа неспаренных электронов и определяется общим числом орбиталей на внешнем электронном слое. К ним относятся: а) орбитали с неспаренными электронами; б) орбитали с неподеленными электронными парами; в) свободные орбитали.
Для азота валентность IV является максимальной, потому что внешний электронный слой атома азота (второй энергетический уровень) состоит из четырех орбиталей. Такую валентность азот имеет и в таких соединениях, как N2О5, HNО3, NaNО3 и т. п. Например, в молекуле азотной кислоты три ковалентные связи N—O образуются неспаренными электронами атома азота, а одна связь N—О образуется неподеленной парой электронов атома азота:
Ионная связь
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ДЭО > 1,7), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование частиц, имеющих электрические заряды. Эти Частицы называются ионами:
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Ионную связь можно рассматривать как крайний случай ковалентной полярной связи.
Как вы уже знаете, наименьшую ЭО имеют типичные металлы, атомы которых наиболее легко отдают электроны, а наибольшую ЭО имеют типичные неметаллы, атомы которых легко присоединяют электроны: Поэтому ионная связь образуется между атомами типичных металлов и атомами типичных неметаллов.
При отдаче электронов атомы металлов превращаются в положительно заряженные ионы, которые называются катионами, например:
Na0 — 1ē→Na+ — катион натрия;
Ca0 — 2ē→Ca2+ — катион кальция.
При присоединении электронов атомы неметаллов превращаются в отрицательно заряженные ионы, которые называются анионами, например:
Cl0 + 1ē→ Cl— — хлорид-анион;
O0 + 2ē→O2- — оксид анион.
Например, образование ионной связи при взаимодействии атомов натрия и хлора схематично можно показать так:
Как видно из этого примера, ионы имеют завершенные электронные конфигурации, т. е. при образовании ионной связи, как и при образовании ковалентной связи, атомы переходят в более устойчивое состояние.
По своим свойствам ионная связь отличается от ковалентной связи. Силы электростатического взаимодействия направлены от данного иона во все стороны. Поэтому данный ион может притягивать ионы противоположного знака в любом направлении. Этим обусловлены ненаправленность и ненасыщаемость ионной связи. В кристаллической решетке ионных соединений вокруг каждого иона располагается определенное число ионов с противоположным зарядом. Например, в кристаллической решетке хлорида натрия NaCl каждый ион натрия Na+ окружен шестью хлорид-ионами Сl—, а каждый хлорид-ион окружен шестью ионами натрия. Таким образом, для ионных соединений понятие «молекула» при обычных условиях теряет смысл.
Существуют вещества, молекулы которых содержат и ионные, и ковалентные связи. К таким веществам относятся, например, щелочи и многие соли. Так, в молекулах гидроксида натрия NaOH и сульфата натрия Na2SО4 связи между атомами натрия и кислорода представляют собой ионные связи, а остальные связи (между атомами кислорода и водорода в NaОН и между атомами кислорода и серы в Na2SО4) — ковалентные полярные.
Металлическая связь
Как известно, атомы металлов более или менее легко отдают электроны, которые находятся на внешнем электронном слое. В результате атомы металлов превращаются в положительно заряженные ионы. Это происходит не только при взаимодействии металлов с другими веществами, но и при образовании простых веществ-металлов.
Простые вещества, которые образуют элементы-металлы, при обычных условиях представляют собой твердые кристаллические вещества (кроме ртути Hg). В кристаллах металлов часть их атомов находится в ионизированном состоянии. В узлах кристаллической решетки металлов находятся положительные ионы и атомы металлов, а между узлами — электроны. Эти электроны становятся общими для всех атомов и ионов металла и могут достаточно свободно перемещаться по всей кристаллической решетке.
Поэтому электроны, которые находятся в кристаллической решетке металлов, называются свободными электронами, или «электронным газом».
Связь между всеми положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов называется металлической связью.
Металлическая связь обусловливает важнейшие физические свойства металлов.
Водородная связь
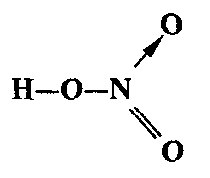
Водородная связь является особым видом химической связи. В образовании этой связи участвует атом водорода, который в данной молекуле уже связан обычной ковалентной связью с атомом какого-либо элемента, имеющего большую электроотрицательность (например, с фтором, кислородом, азотом). Ковалентные связи H—F, Н—О, H—N являются сильно полярными (большая разность ЭО!). Поэтому атом водорода имеет избыточный положительный заряд +5, а на атомах фтора, кислорода и азота находятся избыточные отрицательные заряды:

В результате электростатического взаимодействия происходит притяжение положительно заряженного атома водорода одной молекулы к электроотрицательному атому другой молекулы. Определенный вклад в образование водородной связи вносит донорно-акцепторное взаимодействие «полусвободной» 1s-орбитали атома водорода и орбитали с неподеленной парой электронов электроотрицательного атома:
Это примеры образования межмолекулярных водородных связей. (Водородные связи обозначаются точками). Образование межмолекулярных водородных связей является причиной существования ассоциатов молекул типа (HF)n, (H2O)n и др.
Водородная связь может быть не только межмолекулярной, но и внутримолекулярной. Например, в салициловом альдегиде происходит образование водородной связи между атомом водорода группы —ОН и атомом кислорода группы >С=О:
Внутри- и межмолекулярные водородные связи существуют в молекулах белков, ДНК и др.
Таким образом, при образовании водородной связи атом водорода находится между двумя атомами с высокой ЭО; с одним из них он связан обычной ковалентной связью, а с другим — водородной связью.
Энергия водородной связи приблизительно в десять раз меньше энергии обычной ковалентной связи и варьируется в пределах 15 — 40 кДж/моль. Тем не менее, водородные связи играют важную роль во многих физико-химических и биологических процессах.
Межмолекулярные взаимодействия
Межмолекулярная водородная связь является одним из видов межмолекулярных взаимодействий.
Существуют также универсальные силы взаимодействия между любыми молекулами, которые не приводят к разрыву или образованию новых химических связей. Эти силы называются ван-дер-ваальсовыми силами (в честь голландского физика Ван-дер-Ваальса). Они обусловливают притяжение молекул данного вещества (или различных веществ) друг к другу в жидком и твердом агрегатном состояниях.
Одним из видов ван-дер-ваальсовых сил является ориентационное взаимодействие. Такое взаимодействие возникает между дипольными молекулами; противоположно заряженные концы диполей притягиваются друг к другу.
Если рядом находятся полярная и неполярная молекулы, то под влиянием полярной молекулы в неполярной молекуле возникает (индуцируется) диполь. Постоянный диполь и индуцированный диполь притягиваются друг к другу. Такой вид взаимодействия называется индукционным:
Типы кристаллических решеток твердых веществ

Скачать:
Скачать бесплатно реферат на тему: «Водородная связь» [download id=»1337″]
Скачать бесплатно реферат на тему: «Химическая связь» [download id=»1872″]
Рефераты по другим темам можно скачать здесь












Комментарии 0