Фенолы
Фенолы – это производные ароматических углеводородов, содержащие одну или несколько гидроксильных групп у атомов углерода бензольного кольца.
Номенклатура и изомерия
Возможны два типа изомерии: изомерия положения заместителей в бензольном кольце и изомерия боковой цепи. Многие фенолы имеют тривиальные названия.
Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Фенол С6Н5ОН (карболовая кислота) — бесцветное кристаллическое вещество, toплав.= 43оС, toкип. = 182оС, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66оС смешивается с водой в любых соотношениях. Фенол – токсичное вещество, вызывает ожоги кожи, является антисептиком.
Химические свойства
Химические свойства фенолов обусловлены наличием в их молекулах функциональной группы – ОН и бензольного кольца.
I. Реакции с участием гидроксильной группы
Кислотные свойства
1.Диссоциация в водных растворах с образованием фенолят-ионов и ионов водорода.
2.Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов):
3.Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами):
4.Образующиеся в результате реакций 2) и З) феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов (следовательно, фенол — еще более слабая кислота, чем угольная):
Феноляты используются в качестве исходных веществ для получения простых и сложных эфиров фенола:
II. Реакции с участием бензольного кольца
1.Реакции замещения
Реакции замещения в бензольном кольце фенолов протекают легче, чем у бензола, и в более мягких условиях.
1) Галогенирование

2) Нитрование
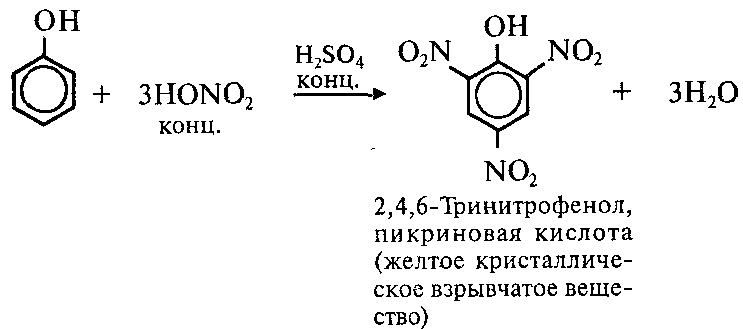
3) Сульфирование

Соотношение о- и n-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при tо=100оС – пара-изомер.
2.Реакции присоединения
Гидрирование

III. Качественные реакции на фенолы
В водных растворах одноатомные фенолы взаимодействуют с хлоридом железа (III) FeCl3 с образованием комплексных фенолятов, которые имеют фиолетовую окраску; после прибавления сильной кислоты окраска исчезает.
Способы получения
1.Из каменноугольной смолы.
Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем — кислотой:
2.Сплавление солей аренсульфокислот со щелочью:
3.Взаимодействие галогенпроизводных ароматических УВ со щелочами:
или водяным паром:

4.Кумольный способ.
В качестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям:

Скачать:
Скачать бесплатно реферат на тему: «Реакции фенолов» [download id=»1717″]
Скачать бесплатно реферат на тему: «Получение фенолов» [download id=»1660″]
Скачать рефераты по другим темам можно здесь












Комментарии 0