Алканы
Общая классификация углеводородов может быть представлена следующей схемой:

Алканы
(предельные или насыщенные УВ, парафины)
CnH2n+2, ≥ 1
Простейшие алканы (прежде всего метан – главная составная часть природного газа) известны с незапамятных времен. Римский историк и естествоиспытатель Плиний Старший в одном из своих сочинений описал горение природного газа, выделявшегося из разломов во время землетрясений. Однако интерес к природному газу как к объекту научного исследования возник лишь во второй половине XVIII в. После опытов Кавендиша с «горючим воздухом» в 1766 г. природный газ некоторое время отождествляли с водородом. Лишь в 1776 г. Алессандро Вольта установил, что в нем содержится углерод. Точный состав метана был определен Джоном Дальтоном в 1805 г. В последующие десятилетия ученым удалось выделить другие простейшие алканы – бутан (1838 г.), этан (1849 г.), пентан (1849 г.), пропан (1857 г.). В 1866 г. А.М.Бутлеров получил изобутан. Но, пожалуй, наиболее принципиальное значение имел разработанный в 1926 г. немецкими химиками Ф.Фишером и Г.Тропшем способ синтеза жидких алканов из оксида углерода (II) и водорода на кобальтовом или никелевом катализаторе при +200оС:
nCO + (2n+1)H2→CnH2n+2 + nH2O.
Эта реакция используется для промышленного производства синтетического бензина.
Алканы – это нециклические УВ, в молекулах которых все атомы углерода находятся в состоянии sp3-гибридизации и связаны друг с другом только σ-связями.
Каждый атом углерода в молекуле алкана связан простыми связями с четырьмя атомами («С» или «Н») и не может присоединять другие атомы. Поэтому алканы и называют предельными, или насыщенными, углеводородами.

Изомерия и номенклатура алканов
Возможна только изомерия цепи. Первые три члена гомологического ряда алканов изомеров не имеют.
Четвертый член гомологического ряда существует в виде двух изомеров:

Для пятого члена гомологического ряда алканов возможно существование трех изомеров:

Согласно международной номенклатуре изомеры с разветвленной цепью углеродных атомов следует рассматривать как производные алкана с самой длинной неразветвленной углеродной цепью.
Правила образования названий разветвленных алканов по международной номенклатуре (ИЮПАК)



Физические свойства алканов
Алканы – бесцветные вещества, легче воды, плохо растворяются в воде.
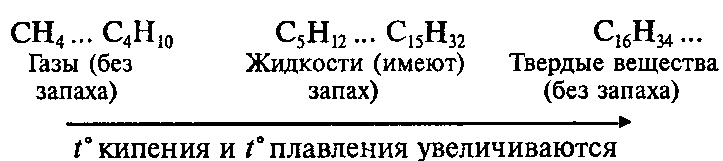
Химические свойства алканов
Историческое название алканов – «парафины» — означает «не имеющие сродства». Алканы химически малоактивны. Низкая реакционная способность алканов обусловлена очень малой полярностью связей С – С и С- Н в их молекулах вследствие почти одинаковой электроотрицательности атомов углерода и водорода.
Для алканов наиболее характерны реакции замещения. В этих реакциях происходит гомолитическое расщепление ковалентных связей, т.е. они осуществляются по свободно-радикальному механизму.
Реакции замещения (разрыв связей С – Н) RH + XY→RX + HY
1.Галогенирование (замещение атома водорода атомом галогена – F, Cl, Br с образованием галогеналкана RHal).
Алканы очень активно реагируют с фтором. Хлорирование протекает под действием света и является фотохимической цепной реакцией. Теорию цепных реакций разработал советский ученый, один из основоположников химической физики, академик Н.Н.Семенов, за что в 1956 г. был удостоен Нобелевской премии. Низшие алканы можно прохлорировать полностью. В молекуле метана атомы хлора могут заместить от одного до четырех атомов водорода в зависимости от соотношения реагентов:
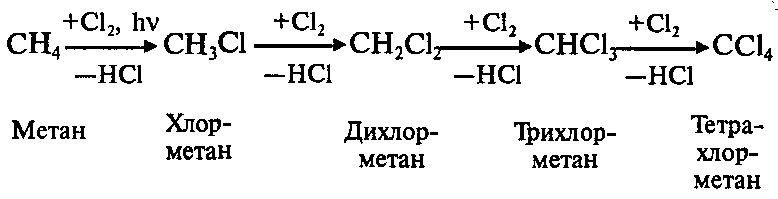
- Нитрование (замещение атома водорода нитрогруппой – NO2 с образованием нитроалканов R- NO2). Нитрующий реагент – азотная кислота HNO3.
а) Нитрование азотной кислотой в газовой фазе при температуре 400о – 500оС:

При этих условиях алканы с большим числом углеродных атомов образуют смесь изомерных нитроалканов, а также нитроалканы с меньшим числом атомов углерода в результате разрыва связей С – С:

б) Нитрование разбавленной HNO3 при to= 140оС и при повышенном или нормальном давлении (реакция М.И. Коновалова).
В результате реакции образуется смесь изомерных нитросоединений. Наиболее легко замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного:

Номенклатура нитро- и галогеналканов
В основе названия нитро- или галогеналкана лежит название самой длинной неразветвленной цепи. Заместители перечисляют в алфавитном порядке. Атомы «С» нумеруют так, чтобы заместитель, который пишется первым, имел меньший номер.

- Сульфирование (замещение атома водорода сульфогруппой – SO3H с образованием алкансульфокислот RSO3H). Сульфирующий реагент – серная кислота H2SO4).
Сульфирование алканов происходит при действии очень концентрированной H2SO4 при небольшом нагревании. Наиболее легко замещается атом водорода у третичного атома углерода:

Номенклатура сульфопроизводных алканов
К названию соответствующего алкана нужно прибавить приставку «сульфо-» или окончание «сульфокислота» с указанием положения сульфогруппы:

Реакции окисления
При обычных условиях алканы устойчивы к действию окислителей (KMnO4, K2Cr2O7).
- Окисление кислородом воздуха при высоких температурах (горение):
а) полное окисление (избыток О2) с образованием углекислого газа и воды:
CH4 + 2O2 → CO2 + 2H2O
б) неполное окисление (недостаток О2):
2CH4 + 3O2 → 2CO + 4H2O
CH4 + O2 → C + 2H2O
- Окисление кислородом воздуха при невысоких температурах в присутствии катализаторов (неполное каталитическое окисление).
В результате могут образоваться альдегиды, кетоны, спирты, карбоновые кислоты.
Термические превращения алканов
- Крекинг – это разрыв связей С-С в молекулах алканов с длинными углеродными цепями, в результате которого образуются алканы и алкены с меньшим числом атомов углерода.
Термический крекинг (пиролиз) осуществляется при температуре 450 – 700оС:
CH3 – CH2 – CH2 – CH3 → CH3 – CH3 + CH2=CH2
CH3 – CH2 – CH2 – CH3 → CH4 + CH2=CH – CH3
- Дегидрирование (отщепление водорода; происходит в результате разрыва связей С – Н; осуществляется в присутствии катализаторов при повышенных температурах).
При дегидрировании метана образуется этин (ацетилен):
2СН4 → С2Н2 + 3Н2
При нагревании метана до 1200оС он разлагается на простые вещества:
СН4 → С + 2Н2
При дегидрировании других алканов образуются алкены:

- Дегидроциклизация (ароматизация, дегидрирование алканов с образованием ароматических соединений):

- Изомеризация (превращение химического соединения в его изомер):

Получение алканов
Получение метана
- В промышленности:
а) из природного газа;
б) синтез из оксида углерода (II) и водорода:
СО + 3Н2 → СН4 + Н2О
- В лаборатории:
а) гидролиз карбида алюминия
Al4C3 + 12H2O → 3CH4↑ + 4Al(OH)3
б) сплавление солей уксусной кислоты со щелочами
CH3COONa + NaOH → CH4↑ + Na2CO3
Получение гомологов метана
- В промышленности :
а) из природного сырья (нефть, газ, горный воск);
б) синтез из оксида углерода (II) и водорода
- В лаборатории:
а) каталитическое гидрирование (+Н2) непредельных УВ
CnH2n + H2 → CnH2n+2
б) взаимодействие галогеналканов с натрием (реакция А.Вюрца).
Происходит димеризация углеродной цепи исходного галогеналкана, образуется алкан с четным числом атомов углерода в цепи:
2R – Br + 2Na → R – R + 2NaBr
2CH3 – Br + 2Na → CH3 – CH3 + 2NaBr
Если в реакции участвуют разные галогеналканы, то образуется смесь алканов:
3R – Br + 3R` — Br + 6Na → R – R + R – R` + R` — R` + 6NaBr
Применение метана

Скачать:
Скачать бесплатно реферат на тему: «Газы нефтяные попутные» [download id=»1349″]
Скачать бесплатно реферат на тему: «Природные источники углеводородов» [download id=»1669″]
Скачать бесплатно реферат на тему: «Природный газ» [download id=»1675″]
Скачать бесплатно реферат на тему: «Метан» [download id=»1561″]
Скачать рефераты по другим темам можно здесь












Комментарии 0